Différences entre les versions de « Maladies chroniques de l'intestin »
| (17 versions intermédiaires par le même utilisateur non affichées) | |||
| Ligne 291 : | Ligne 291 : | ||
===Comment confirmer le diagnostic?=== | ===Comment confirmer le diagnostic?=== | ||
'''Le diagnostic de MICI repose sur un faisceau d’arguments cliniques, biologiques, endoscopiques ou radiologiques'''. | '''Le diagnostic de MICI repose sur un faisceau d’arguments cliniques, biologiques, endoscopiques ou radiologiques'''. | ||
===Biologie standard===[1,2]: | |||
– NFS – CRP – ferritinémie à la recherche d‘un syndrome inflammatoire ; | – NFS – CRP – ferritinémie à la recherche d‘un syndrome inflammatoire ; | ||
| Ligne 305 : | Ligne 304 : | ||
L’absence de signes d’inflammation ne permet pas d’exclure le diagnostic. L’élévation de la CRP n’est pas retrouvée chez tous les patients souffrant de poussée de MC et n’existe qu’en cas de poussée sévère de RC [3,4]. | L’absence de signes d’inflammation ne permet pas d’exclure le diagnostic. L’élévation de la CRP n’est pas retrouvée chez tous les patients souffrant de poussée de MC et n’existe qu’en cas de poussée sévère de RC [3,4]. | ||
''' | ===Qu’apporte le dosage de la calprotectine fécale pour le diagnostic de maladie inflammatoire chronique intestinale ?=== | ||
'''La calprotectine fécale (CF) est un marqueur d’inflammation intestinale dosé dans les selles pour distinguer des atteintes digestives organiques et non organiques'''. | |||
Plusieurs études ont montré l’utilité du dosage de la CF pour différencier les maladies inflammatoires chroniques de l’intestin (MICI) et le syndrome de l’intestin irritable (SII) [1-4]. | |||
En 2013 le NICE recommandait le dosage de la CF chez les « adultes présentant des symptômes gastro-intestinaux inférieurs récents chez lesquels une consultation spécialisée est envisagée en l’absence de suspicion de cancer » et chez les enfants après avis du spécialiste [1]. | |||
Toutefois, le dosage de la CF n’est pas spécifique et ne permet pas de différencier entre les différents types d’atteinte inflammatoire. Des taux élevés de CF ont été retrouvés dans d’autres pathologies du tube digestif et les valeurs seuils ne sont pas bien définies [2,3]. | |||
En 2018 l’agence australienne d’évaluation Medicare Services Advisory Committee (MSAC) a jugé que les estimations diagnostiques publiées étaient hétérogènes et à risque élevé de biais, que les modalités attendues de recours à ce dosage n’étaient pas explicites et qu’il n’existait pas de preuve du bénéfice médical que pourrait apporter ce dosage [in5]. Elle s’est de ce fait prononcée en défaveur de la prise en charge de cette indication par la collectivité. | |||
En 2020 dans son rapport d’évaluation sur l’intérêt du dosage de la calprotectine pour le diagnostic des troubles digestifs chroniques chez les sujets de moins de 50 ans la méta-analyse principale des résultats publiés en population adulte (cinq essais, n=2015, seuil 50 µg/g) a en effet estimé que la calprotectine pourrait omettre en moyenne 20 voire 30 % des pathologies organiques à composante inflammatoire rencontrées (sensibilité : 0,81 ; 0,71-0,88) et pourrait conduire en parallèle à suspecter à tort ce type de pathologie chez 30 voire 50 % des sujets indemnes testés (spécificité : 0,72 ; 0,46-0,88) | |||
En population pédiatrique aucune méta-analyse n’a pu être menée par manque d’essais, les résultats ponctuels disponibles ne permettant pas d’écarter que la calprotectine puisse omettre dans cette population 20 à 40 % des « malades » et puisse conduire en parallèle à suspecter à tort une pathologie organique [5]. | |||
'''L’analyse des données ne permet pas de considérer que la CF puisse le plus souvent rattraper la minorité de pathologies organiques qui pourraient être omises par le couple examen clinique-dosage de CRP [5]''' | |||
'''Références''' | |||
[1]. [https://www.nice.org.uk/guidance/dg11 NICE. Faecal calprotectin diagnostic tests for inflammatory diseases of the bowel. Octobre 2013]. | |||
[2].[https://www.revmed.ch/RMS/2016/RMS-N-535/Calprotectine-fecale-une-utilite-pour-le-generaliste D’Angelo F, Perrier A. Calprotectine fécale : une utilité pour le généraliste ? Rev Med Suisse 2016 ; 12 : 1752-6]. | |||
[3].[https://www.degruyter.com/view/journals/cclm/55/4/article-p474.xml Manceau H, Chicha-Cattoir V, Puy H, Peoc'h K. Fecal calprotectin in inflammatory bowel diseases: update and perspectives. Clin Chem Lab Med. 2017;55(4):474-483. doi:10.1515/cclm-2016-0522]. | |||
[4]. [https://www.journalslibrary.nihr.ac.uk/hta/hta17550/#/abstract Waugh N, Cummins E, Royle P, et al. Faecal calprotectin testing for differentiating amongst inflammatory and non-inflammatory bowel diseases: systematic review and economic evaluation. Health Technol Assess. 2013;17(55):xv-211. doi:10.3310/hta17550]. | |||
[5]. [https://www.has-sante.fr/jcms/p_3189133/fr/interet-du-dosage-de-calprotectine-fecale-pour-le-diagnostic-etiologique-de-troubles-digestifs-chroniques-survenant-chez-des-sujets-de-moins-de-50-ans-sans-signe-d-alarme-ni-elevation-de-la-concentration-serique-de-proteine-c-reactive HAS. Intérêt du dosage de calprotectine pour le diagnostic des troubles digestifs chroniques survenant chez des sujets de moins de 50 ans sans signe d’alarme ni élévation de la concentration sérique de protéine C réactive- Rapport d’évaluation technologique. Mai 2020]. | |||
'''Qualité de la preuve''' : niveau 3 | |||
'''Mots clés''' : maladie inflammatoire chronique intestinale ; diagnostic [''Inflammatory Bowel Diseases ; diagnosis''] | |||
===La calprotectine fécale permet-elle d’évaluer la gravité et l’évolutivité des MICI ?=== | |||
''''' | '''La calprotectine fécale (CF) est un marqueur non spécifique d’une grande diversité de pathologies digestives organiques à composante inflammatoire [1]''' | ||
. | |||
Les émissions fécales sanglantes absentes des simples poussées fonctionnelles accompagnent 40 à 50 % des cas de MC et près de 90 % de ceux de RCH. En l’absence de tel signe discriminant, il est recommandé de recourir à des examens complémentaires biologiques, endoscopiques et éventuellement d’imagerie [1]. | |||
Historiquement l’iléo-colonoscopie a été considérée comme l’étalon or pour évaluer la gravité et le suivi des maladies inflammatoires chroniques intestinales (MICI). L'utilisation de biomarqueurs sériques et fécaux non invasifs tels que la protéine C réactive (CRP) et la calprotectine fécale (CF) a été évaluée chez des patients atteints de MICI pour catégoriser l'activité de la maladie, prévoir la réponse au traitement, identifier les patients à risque de rechute [2-5]. | |||
En 2018 l’agence australienne d’évaluation Medicare Services Advisory Committee (MSAC) a jugé que les estimations diagnostiques publiées étaient hétérogènes et à risque élevé de biais, que les modalités attendues de recours à ce dosage n’étaient pas explicites et qu’il n’existait pas de preuve du bénéfice médical que pourrait apporter ce dosage [in1]. Elle s’est de ce fait prononcée en défaveur de la prise en charge de cette indication par la collectivité. | |||
'''Références''': | En mai 2019 l’Organisation internationale pour l’étude des maladies inflammatoires de l’intestin (IOBD) après une revue systématique des recommandations et publications internationales disponibles sur l’utilisation des biomarqueurs a évalué la validité de la CF pour servir de biomarqueur de l'activité des MICI [3]. Le taux de CF n'a pas été validé en tant que biomarqueur de l'activité des MICI, en raison du manque de fiabilité technique et clinique et de l'évaluation des performances lorsqu'il est utilisé en remplacement de l'endoscopie. Le niveau de calprotectine fécale ne peut être utilisé que comme facteur pronostique de récidive de la maladie chez les patients en rémission après un traitement médical ou chirurgical. | ||
En 2020 la HAS a évalué l’intérêt du dosage de calprotectine pour le diagnostic de rechute de MICI et le diagnostic étiologique de poussées de symptômes digestifs chez des sujets ne présentant ni évacuation fécale sanglante ni élévation de la concentration sérique de protéine C réactive (CRP). L’étude a impliqué 210 000 sujets suivis pour une maladie de Crohn (MC) ou pour une rectocolite hémorragique (RCH). | |||
Au vu des données disponibles il n’est pas possible de préciser dans quelle mesure la CF améliorerait le repérage des rechutes de MICI comparativement à l’association de l’examen clinique et de la CRP. | |||
'''Face à ces sensibilités et spécificités imparfaites des examens cliniques et biologiques aucun critère n'a été entièrement validé comme substitut d’évaluation du risque de complications de la maladie [1]'''. | |||
'''Références''': | |||
[1] [https://www.has-sante.fr/jcms/c_2854253/fr/interet-du-dosage-de-calprotectine-fecale-pour-le-diagnostic-de-rechute-de-maladie-inflammatoire-chronique-intestinale-mici-chez-des-sujets-ne-presentant-ni-evacuation-fecale-sanglante-ni-elevation-de-la-concentration-serique-de-proteine-c-reactive HAS. Intérêt du dosage de calprotectine pour le diagnostic de rechute de MICI chez des sujets ne présentant ni évacuation fécale sanglante ni élévation de la concentration sérique de protéine C réactive - rapport d’évaluation. Mai 2020]. | |||
[2] [https://pubmed.ncbi.nlm.nih.gov/31327404/ Ma C, Battat R, Khanna R, Parker CE, Feagan BG, Jairath V. What is the role of C-reactive protein and fecal calprotectin in evaluating Crohn's disease activity? Best Pract Res Clin Gastroenterol. 2019;38-39:101602. doi:10.1016/j.bpg.2019.02.004] | |||
[3].[https://www.x-mol.com/paper/5735754 Dulai PS, Peyrin-Biroulet L, Danese S, Sands BE, Dignass A, Turner D, et al. Approaches to Integrating Biomarkers Into Clinical Trials and Care Pathways as Targets for the Treatment of Inflammatory Bowel Diseases. Gastroenterology.2019;157(4):1032-43.] | |||
[4] [https://pubmed.ncbi.nlm.nih.gov/27658156/ Manceau H, Chicha-Cattoir V, Puy H, Peoc'h K. Fecal calprotectin in inflammatory bowel diseases: update and perspectives. Clin Chem Lab Med. 2017;55(4):474-483. doi:10.1515/cclm-2016-0522]. | |||
[5] [https://pubmed.ncbi.nlm.nih.gov/27492691/ Chaabouni T, Manceau H, Peoc'h K. Interest of fecal calprotectine dosage in inflammatory bowel diseases, state of the art and perspectives. Intérêt du dosage de la calprotectine fécale dans les maladies inflammatoires chroniques de l'intestin État des lieux et perspectives. Ann Biol Clin (Paris). 2016;74(4):385-394. doi:10.1684/abc.2016.1172]. | |||
'''Qualité de la preuve''' : niveau 3 | |||
'''Mots clés''' : maladie inflammatoire chronique intestinale ; biomarqueurs ; récidive [''Inflammatory Bowel Diseases ; biomarkers ; recurrence''] | |||
===Sérologies spécifiques=== | |||
Les dosages des ASCA (ac anti-Saccharomyces cerevisiæ, (hors nomenclature) et p-ANCA (ac antineutrophiles cytoplasmiques périnucléaires) sont d’une utilité limitée du fait de leur faible sensibilité et ne font pas partie des tests de bases pour le diagnostic de MICI {Dewit}. Leur étude simultanée aide à différencier RCH et MC [1,2]. 65% des patients atteints de RCH ont des p-ANCA positifs contre 10% dans la maladie de Crohn [3]. | |||
[1] [http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-06/guide_medecin_crohn_web.pdf HAS. Maladie de Crohn. Guide Affection de longue durée. 2008]. | [1] [http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-06/guide_medecin_crohn_web.pdf HAS. Maladie de Crohn. Guide Affection de longue durée. 2008]. | ||
| Ligne 324 : | Ligne 380 : | ||
[2] [http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-06/guide_medecin_rch_web.pdf HAS. Rectocolite hémorragique évolutive. Guide Affection de longue durée. 2008]. | [2] [http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-06/guide_medecin_rch_web.pdf HAS. Rectocolite hémorragique évolutive. Guide Affection de longue durée. 2008]. | ||
[3] [http:// | [3] [http://linkinghub.elsevier.com/retrieve/pii/S0755498214005661 Klotz C, Barret M, Dhooge M, Oudjit A, Chaussade S, Coriat R, Abitbol V. Rectocolite hémorragique : conduite diagnostique et prise en charge thérapeutique. Presse med 2015 ;44 (2) :144-9]. | ||
'''Qualité de la preuve''': niveau 3 | |||
'''Mots clés''': Maladie inflammatoire de l’intestin – tests diagnostiques [''IBD– diagnostic tests''] | |||
===Endoscopie=== | |||
Une iléo-coloscopie et une œsogastroscopie avec biopsies permettent de caractériser les lésions, leur sévérité et leur extension [1]: discontinues à prédominance iléale et sténoses fréquentes dans la MC ; continues sans atteinte iléale et rares sténoses dans la RCH. | |||
Imagerie : entéro-scanner, entéro-IRM, vidéo capsule endoscopique peuvent aider dans des cas difficiles [2,3]. | |||
'''Aucun test ne peut à lui seul confirmer le diagnostic. L’endoscopie demeure souvent l’examen de référence pour affirmer/infirmer l’organicité des symptômes digestifs observés et conclure, le cas échéant, à la survenue d’une rechute de MICI. Cette endoscopie ne peut néanmoins pas être systématique, compte tenu de ses contraintes et de son risque, rare mais non nul, d’effets indésirables''' [4]. | |||
'''Références''': | |||
[1] [http://linkinghub.elsevier.com/retrieve/pii/S0755498214005661 Klotz C, Barret M, Dhooge M, Oudjit A, Chaussade S, Coriat R, Abitbol V. Rectocolite hémorragique : conduite diagnostique et prise en charge thérapeutique. Presse med 2015 ;44 (2) :144-9]. | |||
[2] [http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-06/guide_medecin_crohn_web.pdf HAS. Maladie de Crohn. Guide Affection de longue durée. 2008]. | |||
[3] [http://www.has-sante.fr/portail/upload/docs/application/pdf/2008-06/guide_medecin_rch_web.pdf HAS. Rectocolite hémorragique évolutive. Guide Affection de longue durée. 2008]. | |||
[4] [ | [4] [https://www.has-sante.fr/jcms/c_2854253/fr/interet-du-dosage-de-calprotectine-fecale-pour-le-diagnostic-de-rechute-de-maladie-inflammatoire-chronique-intestinale-mici-chez-des-sujets-ne-presentant-ni-evacuation-fecale-sanglante-ni-elevation-de-la-concentration-serique-de-proteine-c-reactive HAS. Intérêt du dosage de calprotectine pour le diagnostic de rechute de MICI chez des sujets ne présentant ni évacuation fécale sanglante ni élévation de la concentration sérique de protéine C réactive - rapport d’évaluation. Mai 2020]. | ||
'''Qualité de la preuve''': niveau 3 | '''Qualité de la preuve''': niveau 3 | ||
| Ligne 374 : | Ligne 448 : | ||
==Bibliomed== | ==Bibliomed== | ||
* [http://www. | * [http://www.unaformec.org/uploads/Publications/bibliomed/776_Colon_irritable_Approche_clinique.pdf Collectif. Syndrome de l’intestin irritable (SII): une approche clinique. Bibliomed 2015;776]. | ||
* [http://www. | * [http://www.unaformec.org/uploads/Publications/bibliomed/778_Colon%20irritable_Traitement.pdf Collectif Syndrome de l’intestin irritable : que proposer à nos patients ? Bibliomed 2015;778]. | ||
* [http://www. | * [http://www.unaformec.org/uploads/Publications/bibliomed/784_Maladies_inflammatoires_Intestin.pdf Collectif Maladies inflammatoires chroniques de l’intestin. Quels repères en 2015 ? Bibliomed 2015;784]. | ||
Version actuelle datée du 29 juin 2020 à 18:45
Projet collaboratif et formulaire pour poster vos questions et/ou vos commentaires
Ce wiki est un projet collaboratif, auquel chacun peut apporter sa pierre, soit par les questions issues de sa pratique pour lesquelles les réponses sont incertaines ou absentes, soit par les réponses qu'il souhaite lui-même apporter.
Vous devez pour cela vous entrer votre question ou votre commentaire en utilisant notre formulaire en ligne ici...
Syndrome de l’intestin irritable
Quels sont la fréquence et l’impact du syndrome de l’intestin irritable (SII) en termes de santé publique?
Le syndrome de l’intestin irritable est une entité clinique dont la prévalence, la répercussion sur la qualité de vie des individus et les coûts de santé générés sont importants.
Le syndrome de l’intestin irritable est un trouble gastro-intestinal chronique dont la prévalence est estimée en Europe et Amérique du Nord entre 10 et 15% [1] et l’incidence mondiale entre 196 et 260 pour 100 000 personnes / an [2]. Il concerne le plus souvent des adultes entre 20 et 30 ans, deux fois plus souvent les hommes que les femmes. Les études récentes indiquent qu’il y a également une prévalence significative chez les personnes âgées [3].
Le SII a des répercussions importantes sur la qualité de vie des patients influençant le fonctionnement social, la qualité du sommeil, les capacités relationnelles.
Comparativement à la population générale il est plus souvent associé à des troubles dépressifs (30% vs 18%) ou anxieux (16% vs 6%) ; les patients se plaignant de SSI consultent leur médecin plus souvent (1,6 consultation/3 mois versus 0,8), consomment plus de médicaments (69% des patients consomment des médicaments pour des symptômes liés au SII) et s’absentent du travail plus souvent (5,5 jours/an versus 3,1) [4,5].
La majorité des consultations pour SII se font en soins de premiers recours (77% vs 43% en gastroentérologie). Aux USA le SII est responsable de plus de 3 millions de consultations ambulatoires annuelles et 5,9 millions de prescriptions pour un coût total de 20 milliards de dollars.
Références:
[4] Syndrome de l’intestin irritable : un diagnostic d’exclusion? Rev Med Suisse 2012 ; 8 : 1821-5.
Qualité de la preuve: niveau 2.
Mots clés : Syndrome du colon irritable – épidémiologie [Irritable bowel syndrome – epidemiology].
Sur quels éléments cliniques évoquer un syndrome de l’intestin irritable ?
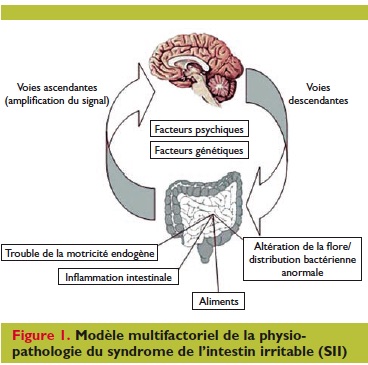
Le SII répond à un modèle multifactoriel et la première difficulté est d’établir un profil symptomatique du patient.
Le SII ne correspond pas à une entité clinique bien définie mais à un ensemble de causes diverses : altération de la flore, de la motricité et de la perméabilité intestinales, modifications des défenses immunitaires, interactions neuro-végétatives, y compris le statut psycho-social [1].
Certains symptômes sont caractéristiques. Le diagnostic doit être évoqué chez un patient présentant depuis au moins 6 mois des douleurs ou un inconfort abdominal, soulagé par la défécation ou associé à une modification de la fréquence et de la forme des selles [2,3].
Pour retenir le diagnostic de SII ces troubles doivent être accompagnés d’au moins deux des quatre symptômes suivants [2,3].
- Troubles de la défécation (obligation de forcer, urgences, sensations d’exonération incomplète ;
- Ballonnement abdominal (plus fréquent chez la femme que chez l’homme) avec modification du transit intestinal ;
- Aggravation par l’ingestion d’aliments ;
- Émission de glaires.
D’autres symptômes tels que léthargie, nausées, dorsalgies, douleurs vésicales, lien avec des facteurs émotionnels sont fréquents et peuvent aider à étayer le diagnostic [1-3]. Environ 20% des patients ayant des problèmes d’incontinence sphinctérienne en parleront mais seulement si la question est posée.
Les critères de Rome III sont actuellement utilisés comme critères de référence : douleurs ou inconfort au moins 3 jours / mois depuis au moins 6 mois + amélioration par la défécation et/ou modification de la fréquence et/ou de la consistance des selles. Ils définissent 3 sous-groupes compte tenu de l’aspect des selles mieux corrélé que leur fréquence à l’évaluation du transit : SSI avec diarrhée (SSI-D= selles défaites > 25% du temps et selles dures < 25%) plus fréquent chez l’homme, avec constipation (SSI-C = selles dures > 25% et selles molles < 25%) plus fréquent chez la femme, et mixte (SSI-M = selles molles et selles dures > 25%). Ils permettront d’orienter le traitement [4].
La douleur et l’inconfort abdominal sont les symptômes clés. Il est important de préciser leur siège qui peut être n’importe où dans l’abdomen et leurs variations et de rechercher systématiquement des signes d’alarme de pathologie organique justifiant des explorations complémentaires [2].
Références
Qualité de la preuve : niveau 3
Mots clés: Syndrome du colon irritable – diagnostic [Irritable bowel syndrome – diagnosis].
Qu’est-il important de rechercher chez un patient présentant des symptômes d’intestin irritable?
La recherche par l’interrogatoire et l’examen clinique de signes d’alarme (Red flags) est essentielle pour identifier les patients présentant une plus grande probabilité de pathologie organique et nécessitant une prise en charge spécifique [1,2].
Signes d’alerte de pathologie organique :
- Survenue après 50 ans ;
- Aggravation progressive des symptômes ;
- Perte de poids non intentionnelle et inexpliquée ;
- Modifications du transit intestinal avec selles plus liquides et/ou plus fréquentes ;
- Diarrhée nocturne ;
- Rectorragies ou melœna;
- Anomalies à l’examen clinique (masse abdominale, signes d’anémie).
- Antécédents familiaux de pathologies gastro-intestinales, de cancer du colon ou de l’ovaire, de maladie cœliaque, de maladie inflammatoire de l’intestin;
Origine iatrogène alimentaire ou médicamenteuse:
- Calcium, magnésium, fer ;
- Antihistaminiques, AINS, antibiotiques, antidépresseurs, antiparkinsoniens, antipsychotiques, inhibiteurs calciques, diurétiques, metformine, opioïdes, sympathicomimétiques [1-3].
Références :
Qualité de la preuve : niveau 3
Mots clés : Syndrome du colon irritable – diagnostic [Irritable bowel syndrome – diagnosis].
Comment confirmer le diagnostic ?
En l’absence de tout signe d’alarme les patients qui remplissent tous les critères cliniques de diagnostic de SII ne présentent pas plus souvent de maladie organique intestinale que les patients asymptomatiques[1].
Il existe une grande incertitude concernant les limites et associations entre SII et maladie inflammatoire intestinale. Les données de la littérature et les recommandations internationales (American College of Gastroenterology Task Force, World Gastroenterolgy Organisation, British Society of Gastroenterology) suggèrent que chez les patients qui remplissent les critères cIiniques de SII sans signe d’alarme le diagnostic peut être posé avec confiance sur la base de la clinique seule [1,2].
Coloscopie: une étude cas contrôle (466 patients suspects de SII et 451 témoins en bonne santé) a montré une prévalence de lésions inflammatoires microscopiques de 1,5% (7/466) dans le groupe SII et 2,3% dans le groupe témoin ≥ 45 ans : une coloscopie de routine n’est donc pas justifiée chez des patients présentant des signes caractéristiques de SII sans autre signe d’appel.
Calprotectine fécale et CRP : au vu des différentes études ayant évalué l’apport de ces tests sanguins et/ou examens de selles [1-3], il n’y a aucune preuve de leur intérêt. Ils ne sont donc pas recommandés en routine chez des patients présentant des signes caractéristiques de SSI en dehors de signes d’alarme évocateurs de maladie inflammatoire : risque de maladie inflammatoire intestinale <1% si calprotectine fécale (hors nomenclature) <40μg/g ou CRP <0,5 mg/dl [3].
Seule exception, la maladie cœliaque qui semble présenter une prévalence supérieure chez les personnes souffrant de SSI par rapport à la population générale. La recherche d’anticorps anti-endomysium et antitransglutaminase est recommandée chez les patients présentant un SII avec diarrhée ou mixte [1,4].
La surveillance, la non réponse au traitement malgré une prise en charge optimale, l’apparition de nouveaux symptômes qui évoqueraient une maladie organique associée détermineront l’indication d’explorations complémentaires.
Références:
Qualité de la preuve : niveau 3
Mots clés: Syndrome du colon irritable – diagnostic [Irritable bowel syndrome – diagnosis].
Quels traitements peut-on proposer?
La prise en charge du SII repose sur une approche individuelle globale incluant le mode de vie, la diététique, les traitements médicaux et comportementaux [1].
D’abord une démarche éducative: être à l’écoute du patient, s’enquérir de son mode de vie (alimentation, sédentarité), informer sur la nature des troubles, leur bénignité et la visée symptomatique des traitements disponibles [2].
Conseils diététiques : prendre le temps de manger ; éviter de sauter des repas ; boire au moins 8 verres de liquide/jour : eau, boissons non caféinées, tisanes ; limiter café, thé (3 tasses/jour), alcool et boissons gazeuses ; limiter légumineuses, maïs, pommes de terre insuffisamment cuites, banane, pain (non digérés dans l’intestin grêle), fruits (3 portions d’environ 80g/jour [Grade C]) ; céréales d’avoine le matin ou 1 cuiller à soupe/jour de graines de lin en cas de ballonnements; éviter le sorbitol (boissons, friandises et produits sans sucre) en cas de diarrhée prédominante [2].
Fibres : dans 17 études (1363 patients), les fibres insolubles (son de blé et maïs) ont le même effet que le placebo et peuvent aggraver les symptômes. Leur consommation doit être adaptée ; en cas de constipation prédominante, privilégier les fibres solubles (poudre de spaghula ou flocons d’avoine) (Grade C) [2,3].
Probiotiques: une étude observationnelle sur 76 patients consommant 2 yaourts/jour, enrichis (43 patients) ou non (33) en probiotiques n’a pas montré, à 4 semaines, de différence significative entre les deux groupes, actif et placebo (57% vs 53% ; p = 0,71) [4].
Un régime d’exclusion ne sera envisagé, si les symptômes persistent, qu’après avis diététique spécialisé. Une allergie est rare mais une intolérance est fréquente, par exemple aux fibres insolubles.
Activité physique. Dans une étude chez 39 patients (moyenne d’âge 45 ans) suivis 5,2 ans, passer de 3,2 à 5,2 h/semaine d’activité physique améliorait le score de sévérité du SII (218 vs 276 ; p=0,001), la qualité de vie, la fatigue, la dépression, et l’anxiété [5].
Références.
Qualité de la preuve: niveau 3
Mots clés: Syndrome du colon irritable – traitement [Irritable bowel syndrome –treatment].
Quelle est l’efficacité des divers traitements médicamenteux?
Dans tous les essais randomisés l’effet placebo des médicaments est important, représentant près de 47%.
Antispasmodiques anticholinergiques ou musculotropes : une méta analyse (56 études et 3725 patients) [1] a montré qu’ils sont significativement plus efficaces que le placebo sur les douleurs abdominales (RR 1,32 ; IC 95% 1,12 – 1,55 ; p<0,001 ; NNT = 7), le bien être global (1,49 ; 1,25-1,77 ; p<0,0001 ; NNT = 5) et le score de sévérité (1,86 ; 1,26 – 2,76 ; p<0,01 ; NNT=3).
Antidépresseurs : la même méta analyse a montré un bénéfice significatif des antidépresseurs sur les douleurs abdominales (RR 1,49 ; 1,05-2,12 ; p = 0,03 ; NNT = 5), le bien être global (1,57 ; 1,23-2,00 ; p < 0,001 ; NNT = 4), le score de sévérité (1,99 ; 1,32-2,99; p = 0,001; NNT = 4). Les IRSS étaient plus efficaces sur le bien être global, les tricycliques sur les douleurs abdominales et le score de sévérité.
Modificateurs du transit: laxatifs (sauf lactulose) ou ralentisseurs (lopéramide), selon la prédominance de constipation ou de diarrhée, en ajustant la dose à la réponse clinique [2].
Références:
Qualité de la preuve: niveau 3
Mots clés : Syndrome du colon irritable – traitements médicamenteux [Irritable bowel syndrome – drug therapy].
Y a-t-il d’autres possibilités de prises en charge?
Interventions psycho-comportementales: une revue de 25 études n’a pas montré de différence significative entre psychothérapies, TCC ou relaxation vs groupes témoins6. Ces thérapies peuvent être envisagées en cas de SII persistant après 12 mois de prise en charge diététique et pharmacologique1. Dans 4 études (147 patients) de faible qualité, l’hypnothérapie n’est pas plus efficace que la psychothérapie ou le placebo [1].
Autres traitements. Dans 5 études de faible qualité, l’acupuncture n’était pas plus efficace que le Bifidus (1,07 ; 0,90-1,27) sur 181 patients ou que la psychothérapie (1,05 ; 0,87 – 1,26) sur 100 patients [2].
Dans 51 essais comparant différents protocoles homéopathiques au traitement conventionnel, 22 montraient un bénéfice et 29 aucune différence. Dans une méta analyse de 2 petites études (129 participants présentant un SII avec constipation - SII-C) il n’y avait pas de différence significative dans l’amélioration globale entre les remèdes homeopathiques (Asafœtida - Nux Vomica) et le placebo sur un suivi à très court terme (2 semaines). La qualité de la preuve était considérée comme très faible en raison d’un risque élevé de biais et des données éparses [3].
Références
Qualité de la preuve: niveau 3
Mots clés: Syndrome du colon irritable – traitement [Irritable bowel syndrome – treatment].
Maladies Inflammatoires Chroniques de l’Intestin (MICI)
Quelles sont la fréquence et les conséquences des maladies inflammatoires chroniques de l’intestin ?
Les Maladies Inflammatoires Chroniques de l’Intestin (MICI), maladies de Crohn (MC) et Rectocolite Hémorragique (RCH), sont fréquentes dans les pays développés, principalement chez les jeunes.
Le nombre estimé de patients souffrant de MICI dans le monde serait de 2,5 millions en Europe comme en Amérique du Nord. L’incidence et la prévalence augmentent régulièrement : 10 nouveaux cas en France/100 000 hab/an [1,2]. Les données du registre EPIMAD [3] sur 571 patients du Nord de la France ont montré sur 5 ans une progression de l’incidence globale de 7,3 à 9,6/100 000 habitants soit une augmentation de 120% et 170% respectivement pour la MC et la RCH.
Les MICI sont le plus souvent diagnostiquées chez des sujets jeunes âgés de 20 à 30 ans mais peuvent se révéler à tout âge. 15% des cas concernent des enfants.
Leur évolution est variable, accompagnée dans environ 20% des cas de complications sévères pouvant imposer une hospitalisation, un arrêt de l’alimentation et un traitement par perfusion [4].
La cause des MICI reste inconnue, multifactorielle. Chez des migrants le risque de MICI rejoint celui de la population d’accueil, d’où un rôle possible de facteurs environnementaux: pollution, hygiène, alimentation, antibiotiques, appendicectomies, tabac, sans qu’aucune étude ne permette de le confirmer [4,5].
Les MICI sont associées à un risque accru de cancer colorectal principalement lorsque les lésions sont présentes au niveau du colon, multiplié par 2 à 2,5 par rapport à la population générale après 10 ans d’évolution de la maladie. Le risque est plus élevé chez les hommes (RR 2,6 ; IC 95 : 2,2-3,1) que chez les femmes (RR 1,9 ; 1,5-2,4) [6].
Les MICI entraînent un handicap fonctionnel majeur avec un retentissement important sur la qualité de vie.
Références :
[3] Registre des Maladies Inflammatoires Chroniques du Tube Digestif (EPIMAD).
[4] INSERM. Maladies inflammatoires chroniques de l’intestin (MICI). Mai 2011.
Qualité de la preuve: niveau 2.
Mots clés: Maladie inflammatoire de l’intestin – épidémiologie [IBD– epidemiology].
Devant quels symptômes penser à une MICI?
La MC et la RCH se caractérisent toutes deux par une inflammation de la paroi d’une partie du tube digestif.
De multiples situations sont évocatrices de MICI [1-3].
– Douleurs abdominales inexpliquées ;
– Diarrhées prolongées, parfois sanglantes, ou gastro-entérites qui se prolongent ;
– Lésions proctologiques : abcès, fissures, fistules complexes et/ou récidivantes ;
– Épisode(s) subocclusif(s) ou occlusif(s) évocateurs de sténose;
– Signes généraux : fatigue, anorexie, fièvre, associés à des signes de malabsorption ;
– Manifestations extra digestives (articulaires, cutanées, oculaires, hépatiques) ;
– Retard de croissance chez l’enfant ;
Des formes légères de maladie de Crohn, pauci-symptomatiques, peuvent être interprétées comme de simples troubles fonctionnels, et cause de retard de diagnostic [2,3].
Dans la rectocolite hémorragique la symptomatologie est souvent plus bruyante et le début plus brutal du fait de l’atteinte rectale quasi systématique : syndrome rectal avec diarrhées, urgences, faux besoins, ténesme, sang dans les selles [2,3].
Références:
[1] INSERM. Maladies inflammatoires chroniques de l’intestin (MICI). Mai 2011.
[2] Dewit O. Maladies inflammatoires intestinales : diagnostic et prise en charge.
Qualité de la preuve : niveau 2.
Mots clés: Maladie inflammatoire de l’intestin – caractéristiques cliniques [IBD– Clinical characteristics].
Comment confirmer le diagnostic?
Le diagnostic de MICI repose sur un faisceau d’arguments cliniques, biologiques, endoscopiques ou radiologiques. ===Biologie standard===[1,2]:
– NFS – CRP – ferritinémie à la recherche d‘un syndrome inflammatoire ;
– Créatininémie à la recherche d’une néphropathie ;
– Fonction hépatique : ALAT, Gamma GT, phosphatases alcalines.
– Albuminémie, vitamine B12 et folates sériques pour évaluer l’état nutritionnel.
L’absence de signes d’inflammation ne permet pas d’exclure le diagnostic. L’élévation de la CRP n’est pas retrouvée chez tous les patients souffrant de poussée de MC et n’existe qu’en cas de poussée sévère de RC [3,4].
Qu’apporte le dosage de la calprotectine fécale pour le diagnostic de maladie inflammatoire chronique intestinale ?
La calprotectine fécale (CF) est un marqueur d’inflammation intestinale dosé dans les selles pour distinguer des atteintes digestives organiques et non organiques.
Plusieurs études ont montré l’utilité du dosage de la CF pour différencier les maladies inflammatoires chroniques de l’intestin (MICI) et le syndrome de l’intestin irritable (SII) [1-4].
En 2013 le NICE recommandait le dosage de la CF chez les « adultes présentant des symptômes gastro-intestinaux inférieurs récents chez lesquels une consultation spécialisée est envisagée en l’absence de suspicion de cancer » et chez les enfants après avis du spécialiste [1].
Toutefois, le dosage de la CF n’est pas spécifique et ne permet pas de différencier entre les différents types d’atteinte inflammatoire. Des taux élevés de CF ont été retrouvés dans d’autres pathologies du tube digestif et les valeurs seuils ne sont pas bien définies [2,3].
En 2018 l’agence australienne d’évaluation Medicare Services Advisory Committee (MSAC) a jugé que les estimations diagnostiques publiées étaient hétérogènes et à risque élevé de biais, que les modalités attendues de recours à ce dosage n’étaient pas explicites et qu’il n’existait pas de preuve du bénéfice médical que pourrait apporter ce dosage [in5]. Elle s’est de ce fait prononcée en défaveur de la prise en charge de cette indication par la collectivité.
En 2020 dans son rapport d’évaluation sur l’intérêt du dosage de la calprotectine pour le diagnostic des troubles digestifs chroniques chez les sujets de moins de 50 ans la méta-analyse principale des résultats publiés en population adulte (cinq essais, n=2015, seuil 50 µg/g) a en effet estimé que la calprotectine pourrait omettre en moyenne 20 voire 30 % des pathologies organiques à composante inflammatoire rencontrées (sensibilité : 0,81 ; 0,71-0,88) et pourrait conduire en parallèle à suspecter à tort ce type de pathologie chez 30 voire 50 % des sujets indemnes testés (spécificité : 0,72 ; 0,46-0,88)
En population pédiatrique aucune méta-analyse n’a pu être menée par manque d’essais, les résultats ponctuels disponibles ne permettant pas d’écarter que la calprotectine puisse omettre dans cette population 20 à 40 % des « malades » et puisse conduire en parallèle à suspecter à tort une pathologie organique [5].
L’analyse des données ne permet pas de considérer que la CF puisse le plus souvent rattraper la minorité de pathologies organiques qui pourraient être omises par le couple examen clinique-dosage de CRP [5]
Références
[1]. NICE. Faecal calprotectin diagnostic tests for inflammatory diseases of the bowel. Octobre 2013.
Qualité de la preuve : niveau 3
Mots clés : maladie inflammatoire chronique intestinale ; diagnostic [Inflammatory Bowel Diseases ; diagnosis]
La calprotectine fécale permet-elle d’évaluer la gravité et l’évolutivité des MICI ?
La calprotectine fécale (CF) est un marqueur non spécifique d’une grande diversité de pathologies digestives organiques à composante inflammatoire [1] . Les émissions fécales sanglantes absentes des simples poussées fonctionnelles accompagnent 40 à 50 % des cas de MC et près de 90 % de ceux de RCH. En l’absence de tel signe discriminant, il est recommandé de recourir à des examens complémentaires biologiques, endoscopiques et éventuellement d’imagerie [1].
Historiquement l’iléo-colonoscopie a été considérée comme l’étalon or pour évaluer la gravité et le suivi des maladies inflammatoires chroniques intestinales (MICI). L'utilisation de biomarqueurs sériques et fécaux non invasifs tels que la protéine C réactive (CRP) et la calprotectine fécale (CF) a été évaluée chez des patients atteints de MICI pour catégoriser l'activité de la maladie, prévoir la réponse au traitement, identifier les patients à risque de rechute [2-5].
En 2018 l’agence australienne d’évaluation Medicare Services Advisory Committee (MSAC) a jugé que les estimations diagnostiques publiées étaient hétérogènes et à risque élevé de biais, que les modalités attendues de recours à ce dosage n’étaient pas explicites et qu’il n’existait pas de preuve du bénéfice médical que pourrait apporter ce dosage [in1]. Elle s’est de ce fait prononcée en défaveur de la prise en charge de cette indication par la collectivité.
En mai 2019 l’Organisation internationale pour l’étude des maladies inflammatoires de l’intestin (IOBD) après une revue systématique des recommandations et publications internationales disponibles sur l’utilisation des biomarqueurs a évalué la validité de la CF pour servir de biomarqueur de l'activité des MICI [3]. Le taux de CF n'a pas été validé en tant que biomarqueur de l'activité des MICI, en raison du manque de fiabilité technique et clinique et de l'évaluation des performances lorsqu'il est utilisé en remplacement de l'endoscopie. Le niveau de calprotectine fécale ne peut être utilisé que comme facteur pronostique de récidive de la maladie chez les patients en rémission après un traitement médical ou chirurgical.
En 2020 la HAS a évalué l’intérêt du dosage de calprotectine pour le diagnostic de rechute de MICI et le diagnostic étiologique de poussées de symptômes digestifs chez des sujets ne présentant ni évacuation fécale sanglante ni élévation de la concentration sérique de protéine C réactive (CRP). L’étude a impliqué 210 000 sujets suivis pour une maladie de Crohn (MC) ou pour une rectocolite hémorragique (RCH).
Au vu des données disponibles il n’est pas possible de préciser dans quelle mesure la CF améliorerait le repérage des rechutes de MICI comparativement à l’association de l’examen clinique et de la CRP.
Face à ces sensibilités et spécificités imparfaites des examens cliniques et biologiques aucun critère n'a été entièrement validé comme substitut d’évaluation du risque de complications de la maladie [1].
Références:
Qualité de la preuve : niveau 3
Mots clés : maladie inflammatoire chronique intestinale ; biomarqueurs ; récidive [Inflammatory Bowel Diseases ; biomarkers ; recurrence]
Sérologies spécifiques
Les dosages des ASCA (ac anti-Saccharomyces cerevisiæ, (hors nomenclature) et p-ANCA (ac antineutrophiles cytoplasmiques périnucléaires) sont d’une utilité limitée du fait de leur faible sensibilité et ne font pas partie des tests de bases pour le diagnostic de MICI {Dewit}. Leur étude simultanée aide à différencier RCH et MC [1,2]. 65% des patients atteints de RCH ont des p-ANCA positifs contre 10% dans la maladie de Crohn [3].
[1] HAS. Maladie de Crohn. Guide Affection de longue durée. 2008.
[2] HAS. Rectocolite hémorragique évolutive. Guide Affection de longue durée. 2008.
Qualité de la preuve: niveau 3
Mots clés: Maladie inflammatoire de l’intestin – tests diagnostiques [IBD– diagnostic tests]
Endoscopie
Une iléo-coloscopie et une œsogastroscopie avec biopsies permettent de caractériser les lésions, leur sévérité et leur extension [1]: discontinues à prédominance iléale et sténoses fréquentes dans la MC ; continues sans atteinte iléale et rares sténoses dans la RCH.
Imagerie : entéro-scanner, entéro-IRM, vidéo capsule endoscopique peuvent aider dans des cas difficiles [2,3].
Aucun test ne peut à lui seul confirmer le diagnostic. L’endoscopie demeure souvent l’examen de référence pour affirmer/infirmer l’organicité des symptômes digestifs observés et conclure, le cas échéant, à la survenue d’une rechute de MICI. Cette endoscopie ne peut néanmoins pas être systématique, compte tenu de ses contraintes et de son risque, rare mais non nul, d’effets indésirables [4].
Références:
[2] HAS. Maladie de Crohn. Guide Affection de longue durée. 2008.
[3] HAS. Rectocolite hémorragique évolutive. Guide Affection de longue durée. 2008.
Qualité de la preuve: niveau 3
Mots clés: Maladie inflammatoire de l’intestin – tests diagnostiques [IBD– diagnostic tests]
Quels sont les traitements possibles ?
Il n’y a pas de traitement curatif des MICI.
Traitement de crise.
– Amino salycilates (5-ASA) en 1ère intention. Les effets indésirables (10 à 45%) sont dose dépendants (nausées, épigastralgies, diarrhée, pancréatites, Stevens Johnson) [1].
– Corticostéroïdes, en cas d’échec des 5-ASA, avec 50% de risques d’effets systémiques parfois sévères dans des traitements dépassant 12 semaines : ostéoporose, ostéonécrose de la tête fémorale, myopathies, cataracte [1,2].
Traitement de fond.
– Immunomodulateurs efficaces dans le maintien des rémissions (MC et RCH). Sur 83 patients après 3,5 ans de traitement par azathioprine (AZA) et poursuite pendant 18 mois de l’AZA vs placebo, les taux de rechutes étaient respectivement de 21 et 8% (p=0,0195) [1].
– Biothérapies anti TNF-α dans les formes sévères et résistantes : infliximab ou adalimumab pour la MC, infliximab seulement dans la RCH {INSERM – HAS x 2}. Il n’y a pas de consensus sur la durée du traitement, adapté au cas par cas, ni sur le maintien de l’efficacité à long terme [3].
– L’alimentation n’influe pas sur le cours de la maladie. Des supplémentations (fer, acide folique, zinc) voire une alimentation parentérale peuvent être nécessaires à la demande [4,5].
Chirurgie. En dehors de contextes d’urgence, une chirurgie élective selon l’étendue et la diversité des lésions est réservée aux malades résistant à un traitement médical bien conduit.
La thérapeutique a pour objectif un contrôle durable de la pathologie et le maintien de la qualité de vie.
Références:
[2] INSERM. Maladies inflammatoires chroniques de l’intestin (MICI). Mai 2011.
[3] Kalla R, Ventham NT, Arnott IDR. Crohn’s disease. BMJ. 2014;349:g6670. doi: 10.1136.
[4] HAS. Maladie de Crohn. Guide Affection de longue durée. 2008.
[5] HAS. Rectocolite hémorragique évolutive. Guide Affection de longue durée. 2008.
Qualité de la preuve : niveau 3
Mots clés : Maladie inflammatoire de l’intestin – prise en charge [IBD–disease management]